Literatuurconclusies
Literatuurconclusies psychologische en psychosociale interventies voor nachtelijke onrust bij mensen met dementie
|
laag GRADE |
Er zijn enige aanwijzingen voor de effectiviteit van een wandelinterventie gecombineerd met psycho-educatie over slaapgedrag bij thuiswonende mensen met dementie. |
|
laag GRADE |
Er zijn er enige aanwijzingen voor de effectiviteit van een gecombineerd programma van psycho-educatie en coaching van mantelzorgers op verbetering van het slapen en vermindering van het aantal keren wakker worden bij thuiswonende mensen met dementie. De psycho-educatie en coaching gaan over slaapgedrag en hoe toename van wandelen en blootstelling aan licht te bewerkstelligen. |
|
laag GRADE |
Er is geen bewijs voor de effectiviteit op de slaapduur van een langzame rugmassage voorafgaand op het slapen bij verpleeghuisbewoners met matige tot ernstige dementie. |
Literatuurconclusies lichttherapie voor nachtelijke onrust bij mensen met dementie
|
Laag GRADE |
Er zijn geen aanwijzingen dat lichttherapie effectief is voor nachtelijke onrust bij mensen met dementie. |
|
Laag GRADE |
Een verhoogd risico op het optreden van één of meer bijwerkingen bij lichttherapie kan niet worden aangetoond, noch uitgesloten. |
Literatuurconclusies psychofarmaca voor nachtelijke onrust bij mensen met dementie
Antidepressiva
|
Laag GRADE |
Er zijn beperkte aanwijzingen dat trazodon mogelijk effectief is tegen nachtelijke onrust bij mensen met de ziekte van Alzheimer. |
|
Laag GRADE |
Een verhoogd risico op het optreden van één of meer bijwerkingen bij het gebruik van trazodon kan niet worden aangetoond, noch uitgesloten. |
Hypnotica
|
Laag GRADE |
Er zijn enige aanwijzingen dat melatonine effectief is tegen nachtelijke onrust bij mensen met dementie. |
|
Laag GRADE |
Een verhoogd risico op bijwerkingen bij het gebruik van melatonine kan niet worden aangetoond, noch uitgesloten. |
Zoekvraag (PICO)
Om de uitgangsvraag te kunnen beantwoorden is literatuuronderzoek verricht naar de volgende vraagstelling(en):
“Wat zijn de effecten op nachtelijke onrust van psychosociale en psychologische interventies en lichttherapie vergeleken met controle-interventie of gebruikelijke zorg en psychofarmaca vergeleken met placebo op nachtelijke onrust bij mensen met dementie?”
De bijbehorende zoekvraag (PICO) is:
- P: mensen met dementie en nachtelijke onrust
- I: psychosociale en psychologische interventies, lichttherapie en psychofarmaca
- C: gebruikelijke zorg of controle-interventie voor psychosociale en psychologische interventies en lichttherapie of placebo voor psychofarmaca
- O: reductie van nachtelijke onrust, percentage patiënten met een klinisch relevant effect (‘responders’), bijwerkingen en uitval.
Deze module beschrijft de resultaten van het onderzoek en de aanbevelingen die hieruit volgen. Meer informatie over de opzet van het literatuuronderzoek vindt u onder het tabblad ‘Verantwoording en Methode’.
Zoeken en selecteren psychosociale of psychologische interventies
Gevonden studies
Er is één SR naar agressie gevonden (O’Neil 2011), met daarin drie RCT’s naar slaap. Hiervan is er één geïncludeerd (McCurry, 2005). Daarnaast zijn zeventien RCT’s gevonden. Van zeven RCT’s is de volledige tekst gelezen en vervolgens zijn twee RCT’s geïncludeerd (Harris, 2012; McCurry, 2011). In één van de RCT’s zijn twee verschillende interventies onderzocht (McCurry 2011). Voor de geëxcludeerde studies en redenen van exclusie, zie exclusietabel in bijlage 1.1.
Samenvatting psychosociale of psychologische interventies
Kenmerken van geïncludeerde studies
Tabel 1 biedt een overzicht van kenmerken van de drie geïncludeerde RCT's. Hieronder volgt een korte beschrijving.
Zintuiglijke interventie
In de RCT van Harris (2012; n=40) werd een rugmassage onderzocht bij verpleeghuisbewoners met slaapproblemen. Hierbij werd uitgegaan van minder dan zeven uur ’s nachts slapen. Dit werd gemeten met een bewegingsmonitor, ook wel actigraaf of actimeter genoemd. Dit is een klein apparaat dat lichamelijke activiteit registreert en de patiënt 48 uur bij zich droeg. Deelnemers in de experimentele groep kregen een rugmassage waarbij langzame lange strijkbewegingen werden uitgevoerd. De auteur, tevens geriatrieverpleegkundige (practice nurse) en getraind in deze massagetechniek, voerde de interventie volgens protocol rond bedtijd uit in de slaapkamer van de bewoner gedurende drie minuten. Alle deelnemers kregen verder de gebruikelijke aandacht rond het slapen gaan. Na afloop van de interventie werd eveneens 48 uur een bewegingsmonitor gedragen. De uitkomsten betroffen het aantal minuten slaap, de duur van licht uit tot ontwaken en het percentage slapen.
Wandelinterventie met psycho-educatie en coaching
In de RCT van McCurry (2011) is de effectiviteit van wandelen op nachtelijke onrust onderzocht, bij 65 thuiswonende mensen met dementie . In de wandelgroep werd mantelzorgers geleerd toe te zien op dagelijks 30 minuten aaneengesloten wandelen. In de controlegroep gaven de begeleiders ondersteuning maar geen training of gerichte omgangsadviezen voor de slaapproblemen. Alle deelnemers kregen psycho-educatie over slaapveranderingen die gepaard gaan met het ouder worden, dementie en slaapmaatregelen. Alle mantelzorgers (zowel wandelgroep als controlegroep) kregen drie huisbezoeken van één uur (in week 1, 2 en 8) en twee korte telefonische gesprekken (weken 4 en 6). De begeleiders waren professionals in de zorg op masterniveau. De primaire uitkomstmaten waren minuten wakker zijn gedurende de nacht. Dit werd een week gemeten met een bewegingsmonitor (Micro-Mini Motionlogger actigraph) en een subjectieve maat voor slaapproblemen, de ‘Sleep disorder inventory’, ingevuld door de mantelzorger.
Multi-gecombineerde interventies met psycho-educatie en coaching
Twee RCT’s onderzochten effectiviteit van een combinatie van interventies bij nachtelijke onrust (McCurry, 2005; McCurry, 2011).
In 2005 onderzochten McCurry en collega’s een gedragsinterventie bij 36 thuiswonende mensen met lichte tot ernstige Alzheimerdementie en nachtelijke onrust volgens de NPI en hun mantelzorgers. De interventie was gericht op voorlichting over en gedragstherapeutische behandeling van nachtelijke onrust bij Alzheimer Dementie (‘NITE-AD‘). Bij aanvang kregen alle deelnemers (volwassen inwonende mantelzorgers) informatie over slaapgewoonten, leeftijdsgerelateerde veranderingen in slaapgedrag en tips om slaapgedrag bij mensen met dementie te verbeteren. Aan allen werd gevraagd of zij het slaapgedrag wilden verbeteren. Vervolgens kregen mantelzorgers in de interventiegroep een uitgebreid slaap-educatieprogramma over een goede nachtrust (adviezen slaaphygiëne). Ook kregen zij een training in vaardigheden om nachtelijke onrust te hanteren en te zorgen dat de persoon met dementie overdag voldoende activiteiten had (dagelijks een half uur wandelen) en werd blootgesteld aan licht (zoveel mogelijk wandelen bij daglicht en vanaf de derde week een extra lichtbak (2500 lux) die drie uur voor het slapengaan werd gebruikt). In de eerste drie weken vond wekelijks een sessie plaats, gevolgd door een sessie om de twee weken (gedurende zes weken) om de interventie te monitoren en zo nodig bij te sturen. Het trainingsprogramma was op de mantelzorger en de persoon met dementie afgestemd, rekening houdend met voorkeuren en gewoontes. In de controlegroep kregen de deelnemers algemene adviezen over dementie en mantelzorgondersteuning en werden de mantelzorgers aangemoedigd om één uur per dag een activiteit met hun naaste te ondernemen. Alle deelnemers kregen bij hen thuis zes sessies van één uur in een periode van twee maanden. De interventies werden geprotocolleerd uitgevoerd door een ouderenpsycholoog. Deze RCT had een duur van acht weken. De effectiviteit op het slaap-waakritme werd gemeten met een bewegingsmonitor (actigrafie pols; merk Actillume). Het risico op bias was matig, zie bijlage 2.1.
In de studie van McCurry uit 2011 is een combinatietherapie (NITE-AD) gericht op slaapproblemen vergeleken met een controleconditie bij 66 thuiswonende ouderen met lichte tot ernstige Alzheimerdementie. De combinatietherapie bestond uit: 1) een geïndividualiseerd slaapplan met slaaphygiënemaatregelen, 2) dagelijks 30 minuten aaneengesloten wandelen en 3) lichttherapie (één uur/dag; 2500 lux; volledig spectrum). Overigens kreeg ook een groep psycho-educatie en coaching met een wandelinterventie (zie hierboven) of met een lichtinterventie met (zie literatuur lichttherapie). De groep met de NITE-AD combinatietherapie kreeg zes huisbezoeken van een uur (vier elke week en daarna twee om de week) waarin het individueel slaapplan werd opgesteld en het wandelprogramma en de lichttherapie ingevoerd. In de controlegroep ontvingen de mantelzorgers drie huisbezoeken van één uur (in week 1, 2 en 8) en twee korte telefonische gesprekken (weken 4 en 6). Daarin gaven de begeleiders alleen ondersteuning maar geen training of gerichte omgangsadviezen voor de slaapproblemen. Alle deelnemers kregen folders over slaapveranderingen die gepaard gaan met het ouder worden en dementie en slaapmaatregelen. De begeleiders waren professionals in de zorg op masterniveau. De trial duurde acht weken en de primaire uitkomstmaten waren minuten wakker zijn gedurende de nacht (een week gemeten met een bewegingsmonitor (Micro-Mini Motionlogger actigraph) en een subjectieve maat voor slaapproblemen, de ‘Sleep disorder inventory’, ingevuld door de mantelzorger.
Tabel 1. Kenmerken en kwaliteit van trials over psychosociale interventies voor nachtelijke onrust bij mensen met dementie
|
Publicatie |
Therapie |
Setting |
Dementie (ernst; type) |
Nachtelijke onrust (ernst; criteria) |
N (I/C) |
Duur trial |
Meetinstrument; follow-up |
Kwaliteit opzet en uitvoering1 |
|
Zintuiglijke interventies |
||||||||
|
Harris 2012 |
Rugmassage |
Instelling |
Matig ernstige dementie |
Personeel meldde bewoners aan en vervolgens gecheckt: <7 uur nachtrust (bewegingsmonitor) |
40 (20/20) |
48 uur (2 sessies van 3 min.) |
Bewegingsmonitor (pols), posttest (48 uur monitoring) |
2/6 |
|
Wandelinterventie met psycho-educatie en coaching |
||||||||
|
McCurry 2011 |
Wandelen en psycho-educatie en coaching |
Thuiswonend |
AD |
>2 slaapproblemen gedurende meerdere keren per week (Sleep Disorders Inventory) |
65 (32/33) |
2 mnd |
Bewegingsmonitor (pols); Posttest (1 week monitoring) en vier maanden later |
4/6 |
|
Multi-gecombineerde interventies met psycho-educatie en coaching |
||||||||
|
McCurry 2005 |
Gedragsinterventie en educatie (NITE-AD) |
Thuiswonend |
AD |
>2 slaapproblemen gedurende >3 x per week (NPI) |
36 (17/19) |
2 mnd (6 sessies) |
Bewegingsmonitor (pols) en SDI; Posttest (1 week monitoring) en vier maanden later |
4/6 |
|
McCurry 2011 |
Combinatie (wandelen, licht, slaaphygiëne, psycho-educatie, coaching) (NITE-AD) |
Thuiswonend |
AD |
>2 slaapproblemen gedurende meerdere keren per week (Sleep Disorders Inventory) |
66 (33/33) |
2 mnd |
Bewegingsmonitor (pols); Posttest (1 week monitoring) en vier maanden later |
4/6 |
1 Gescoord volgens de 6 domeinen van de Cochrane Risk of Bias tool 2.0 (score 0-6), waarbij een hogere score een hogere kwaliteit weergeeft en minder risico op bias en overschatting van het behandeleffect (zie tabblad ‘Verantwoording en methode’ voor details over deze beoordeling). AD=Alzheimer dementie; SDI= Sleep Disorders Inventory.
Resultaten en bewijskracht
Zintuiglijke interventie
In de intramurale studie van Harris (2012) is de duur van de slaap onder 40 deelnemers die een rustige rugmassage voor het slapen gaan ontvingen met gemiddeld 46 minuten toegenomen. Bij degenen die de gebruikelijke zorg kregen was er een toename in slaapduur van tien minuten. Uit de ANOVA bleek dit verschil in slaapduur niet significant (p=0,18). Naast slaapduur werden evenmin significante verschillen gevonden op andere slaapuitkomsten, zoals percentage van de tijd in bed slapen (p=0,26) en snelheid van in slaap vallen nadat het licht uit is (p=0,99). De effectgroottes (SMD) kunnen niet worden berekend doordat onvoldoende gegevens zijn gepresenteerd.
Wandelinterventie met psycho-educatie en coaching
In de studie van McCurry (2011) bij 65 thuiswonende mensen met dementie, was de gecombineerde wandelinterventiegroep (n=32) ‘s nacht significant minder lang wakker (33 minuten) dan de controlegroep (n=33)(SMD= -0,50; 95% BI: -0,99 tot -0,01; p=0,05). Op de subjectieve uitkomstmaat (‘Sleep disorders inventory’) werd geen significant verschil gevonden tussen wandelen en de controlegroep (SMD= -0,27; 95% BI: -0,76 tot 0,22). Dit geldt ook voor het slaappercentage (SMD= -0,44; 95% BI: -0,93 tot 0,05) en aantal keren wakker worden (SMD= -0,46; 95% BI: -0,95 tot 0,04).
Multi-gecombineerde interventies met psycho-educatie en coaching
De twee studies (McCurry 2005 en 2011) naar gecombineerde interventies tonen een significante daling in de tijd dat men ‘s nachts wakker lag (gepoolde SMD= -0,59; 95% BI: -0,99 tot -0,19) en nam het percentage van de tijd dat mensen sliepen uit de tijd dat zij in bed lagen toe (gepoold percentage = 56%; 95% BI: 17% tot 96%). Bovendien was het aantal keren wakker per nacht significant gedaald (gepoolde SMD= -0,44; 95% BI: -0,83 tot -0,04). Op de subjectieve ‘Sleep disorder inventory’ werden geen significante effecten gevonden.
In de eerste studie van McCurry (2005) waren 36 thuiswonende mensen met dementie die deelnamen aan de ‘NITE-AD interventie’ in vergelijking met de controlegroep significant minder lang 's nachts wakker (SMD= -0,53; 95% BI: -1,20 tot 0,13). Er was geen verschil in hoe vaak de deelnemers per nacht wakker werden (SMD= -0,62; 95% BI: -1,29 tot 0,05) of in het percentage van de tijd dat zij sliepen (SMD= -0,46; 95% BI: -1,13 tot 0,20). De effecten hielden tot zes maanden follow-up aan. Hoewel alleen mensen met dementie zijn geïncludeerd waarvan de mantelzorgers van te voren hebben aangegeven dat hun naaste meerdere nachten per week slaapproblemen ervoer, kon deze in de voormeting niet bij iedereen objectief worden vastgesteld. Omdat er ook mensen zonder nachtelijke onrust hebben deelgenomen aan de studie is de bewijskracht afgewaardeerd voor indirectheid.
De studie van McCurry in 2011 bij 66 thuiswonende mensen met dementie, toont bij de gecombineerde interventie (NITE-AD) een significante daling van 40 minuten ’s nachts wakker zijn ten opzicht van de controlegroep (SMD=-0,62; 95% BI: -1,12 tot -0,12). Ook het deel van de tijd dat mensen sliepen steeg significant (SMD = -0,62; 95% BI: -1,11 tot -0,12). Er werd geen significant verschil gevonden tussen de gecombineerde interventie en de controlegroep in het aantal keren dat men wakker werd (SMD= -0,34; 95% BI: -0,83 tot 0,14) of op de subjectieve uitkomstmaat ‘Sleep disorders inventory’ (SMD= -0,27; 95% BI: -0,75 tot 0,22).
Tabel 2. Evidenceprofiel over psychologische en psychosociale interventies voor nachtelijk onrustig gedrag bij mensen met dementie
|
Psychologische en sociale interventies |
Trials (N) |
Kwaliteit van het bewijs |
n/N per groep |
Behandeleffecten* |
Algemene beoordeling |
|||||
|
Vertekend1 |
inconsistent |
indirect |
Niet precies2 |
Publicatie bias |
Interventie |
Standaard zorg |
SMD [95% BI] of OR [95% BI] |
|||
|
Zintuiglijke interventie (Harris, 2012) |
||||||||||
|
Slaaptijd (nighttime sleep) |
1 |
ja |
nvt |
nvt |
nvt |
nvt |
20/20 |
20/20 |
I= +46 min.; C= +10 min.; p=0,18 |
zeer laag |
|
Slaap (%) (sleep efficiency) |
1 |
ja |
nvt |
nvt |
nvt |
nvt |
20/20 |
20/20 |
I= +13.8%; C= +9,7%; p=0,26 |
zeer laag |
|
Duur van slapeloze periodes (tijd) (wake after sleep onset) |
1 |
ja |
nvt |
nvt |
nvt |
nvt |
20/20 |
20/20 |
p=0,65 |
zeer laag |
|
Uitval |
1 |
ja |
nvt |
nvt |
nvt |
nvt |
0/20 |
0/20 |
OR=nvt |
zeer laag |
|
Wandelinterventie met psycho-educatie en coaching (McCurry, 2011) |
||||||||||
|
Nachtelijk waken (tijd) |
1 |
ja |
nvt |
Nee |
nvt |
nvt |
27/32 |
29/33 |
SMD= -0,50 [-0,99, -0,01] |
zeer laag |
|
Sleep disorder inventory |
1 |
ja |
nvt |
Nee |
nvt |
nvt |
27/32 |
29/33 |
SMD= -0,27 [-0,76; 0,22] |
zeer laag |
|
Slaap (%) |
1 |
ja |
nvt |
Nee |
nvt |
nvt |
27/32 |
29/33 |
SMD= -0,44 [-0,93; 0,05] |
zeer laag |
|
Aantal keren wakker worden (n) |
1 |
ja |
nvt |
Nee |
nvt |
nvt |
27/32 |
29/33 |
SMD= -0,46 [-0,95; 0,04] |
zeer laag |
|
Uitval |
1 |
ja |
nvt |
Nee |
nvt |
nvt |
5/32 |
2/33 |
OR= 2,87 [0,51; 16,01] |
zeer laag |
|
Multi-gecombineerde interventie (McCurry, 2005 + 2011) |
||||||||||
|
Nachtelijk waken (tijd) |
2 |
ja |
nee |
Ja* |
nee |
nee |
41/50 |
46/52 |
SMD= -0,59 [-0,99; -0,19] |
laag |
|
Sleep disorder inventory |
1 |
ja |
nvt |
Ja* |
nee |
nee |
28/33 |
31/33 |
SMD= -0,27 [-0,75; 0,22] |
zeer laag |
|
Slaap (%) |
2 |
ja |
nee |
Ja* |
nee |
nee |
41/50 |
46/52 |
SMD= -0,56 [-0,96; -0,17] |
laag |
|
Aantal keren wakker worden (n) |
2 |
ja |
nee |
Ja* |
nee |
nee |
41/50 |
46/52 |
SMD= -0,44 [-0,83; -0,04] |
laag |
|
Uitval
|
2 |
ja |
nee |
Ja* |
nee |
nee |
8/50 |
4/52 |
OR=2,30 [0,64; 8,28] |
laag |
* niet alle deelnemers hadden slaapproblemen (ondanks inclusiecriterium; McCurry2005)
Zoeken en selecteren inzet lichttherapie
Gevonden studies
Er werden twee meta-analyses en 34 RCT’s op volledige tekst beoordeeld. Hiervan voldeden vijf RCT’s aan onze selectiecriteria: McCurry (2011), Dowling (2008), Nowak (2008), Fontana-Gasio (2003) en Sloane (2015). Laatstgenoemde leverde geen bruikbare data, doordat de resultaten vóór cross-over niet apart waren gerapporteerd. De overige studies zijn weergegeven in de exclusietabel, zie bijlage 1.2.
Samenvatting literatuur inzet lichttherapie
Kenmerken en kwaliteit van geïncludeerde studies naar lichttherapie voor nachtelijke onrust bij mensen met dementie
Tabel 3 geeft een overzicht van de kenmerken en kwaliteit van de vier geïncludeerde studies.
Twee van de vier RCT’s naar lichttherapie hadden een interventie van volledig spectrum licht (natuurlijk lichtspectrum) met een intensiteit van 2.500 lux gedurende een uur. Bij één RCT werd dit alleen gegeven wanneer bij de gangbare lichtblootstelling deze norm niet werd gehaald (Dowling, 2008); bij de andere studie werd de interventie ongeacht andere blootstelling gegeven (McCurry, 2011). Bij één RCT kregen patiënten een individuele zonneklep met ingebouwd blauwgroen licht met een intensiteit van 12.000 lux (Nowak, 2008). Deze werd gedurende een half uur gedragen. Alle deelnemers in deze studie waren vrouwen. Ook was er een trial met een lichtsimulatie van zonsopgang en zonsondergang, waarbij de lamp met een intensiteit tot 210 lux achter het bed werd gemonteerd (Fontana-Gasio, 2003). De interventie in de controlegroepen bestond uit gebruikelijk licht (Dowling, 2008; McCurry, 2011) of rood licht (Fontana-Gasio, 2003, Nowak 2008).
Studiepopulaties varieerden in ernst van dementie van licht tot ernstig en bestonden vooral uit patiënten met de ziekte van Alzheimer die volgens personeel of de SDI (‘Sleep disorders inventory’, het item ‘slaap’ van de NPI) last hadden van nachtelijke onrust. De omvang van de populaties varieerde van dertien tot 67 deelnemers. Hoewel alle studies patiënten met nachtelijke onrust bij mensen met dementie hadden geselecteerd, was er slechts één studie die een reductie in deze nachtelijke onrust als uitkomst rapporteerde (McCurry, 2011). Deze trial gebruikte de NPI-subschaal over nachtelijke onrust. Alle vier studies gebruikten actimetrie om het effect van lichttherapie bij nachtelijke onrust te meten. Deze resultaten zijn gepoold. Het risico op bias van deze trials was over het algemeen matig, waarbij aangemerkt moet worden dat blindering van de uitkomstbeoordelaar bij lichtinterventies weliswaar een probleem is, maar dat meting met actigrafie ongevoelig is daarvoor.
Tabel 3. Kenmerken en kwaliteit van geïncludeerde RCT’s naar lichttherapie voor nachtelijke onrust bij mensen met dementie
|
Publicatie |
licht (intensiteit; spectrum) |
Blootstelling (duur) |
Setting |
Dementie (ernst; type )1 |
Nachtelijke onrust (ernst; criteria)2 |
N |
Trialduur, weken |
Meetinstrument2 |
Kwaliteit opzet en uitvoering3 |
|
Lichttherapie |
|||||||||
|
McCurry 2011 |
2500 lux; volledig spectrum |
1 uur/dag |
thuis |
licht – ernstig; AD |
SDI en actigrafie |
67 |
8 |
SDI + actigrafie |
4/6 |
|
Dowling 2008 |
min. 2500 lux omgevingslicht, indien nodig aangevuld met lamplicht |
1 uur/dag |
instelling |
licht – ernstig; AD |
personeel |
35 |
10 |
actigrafie |
3/6 |
|
Nowak 2008 |
12.000 lux; blauw-groen licht |
half uur/dag |
instelling |
ernstig; AD, enkel vrouwen |
personeel |
20 |
2 |
actigrafie |
3/6 |
|
Fontana-Gasio 2003 |
simulatie van zonsopgang en –ondergang, tot 210 lux |
gelijk aan lokale schemerduur |
instelling |
licht - ernstig; AD, VaD en andere |
personeel |
13 |
3 |
actigrafie + NPI |
2/6 |
AD: Alzheimer dementie; VaD: Vasculaire dementie; SDI: Sleep Disorders Inventory, 7 items, range 0 – 84, waarbij een hogere score een hogere ernst en/of frequentie betekent (Tractenberg 2003); NPI: Neuropsychiatric Inventory.
Resultaten en bewijskracht over effectiviteit van lichttherapie voor nachtelijke onrust bij mensen met dementie
Tabel 4 toont het evidenceprofiel met de resultaten en bewijskracht over effectiviteit van de geïncludeerde studies.
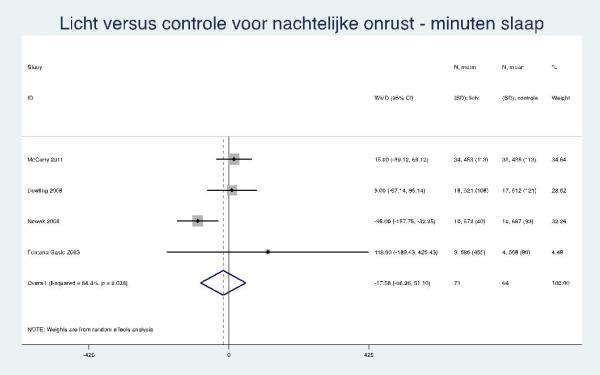
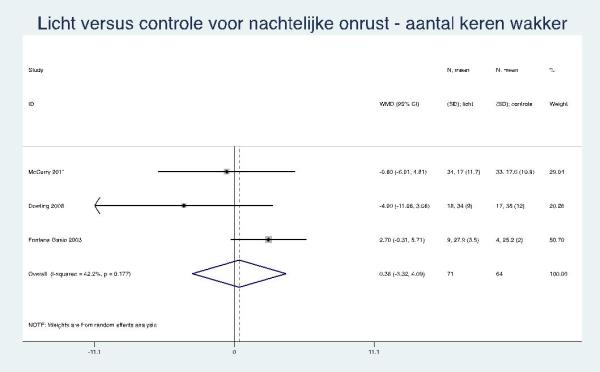
McCurry (2011) rapporteerde een niet statistisch significant gemiddeld verschil van -0,3 tussen de groepen na acht weken op de NPI-subschaal voor slaapstoornissen (baselinescore gemiddeld 1,1). De actigrafiedata uit alle vier trials gaven een gepoolde gemiddelde totale slaaptijd in de interventie versus controlegroep van -18 minuten (95% BI: -86 tot 51) en het aantal wakkere episoden 0,4 (95% BI: -3,3 tot 4,1).
Resultaten en bewijskracht over bijwerkingen van lichttherapie voor nachtelijke onrust bij mensen met dementie
McCurry (2011) rapporteerde geen ernstige bijwerkingen. Nowak rapporteerde dat een patiënt met een geschiedenis van vallen tijdens behandeling met lichttherapie enkele malen viel en de behandeling gestaakt werd. De andere twee trials vermeldden niet of en welke bijwerkingen er waren.
Resultaten en bewijskracht over uitval bij lichttherapie voor nachtelijke onrust bij mensen met dementie
Slechts één trial rapporteerde uitval (McCurry, 2011): hier vielen vijf van de 34 patiënten in de interventiegroep uit versus twee van de 33 in de controlegroep (OR=2,7 (95% BI: 0,5 tot 14,9); risicoverschil=9% (95% BI: -6 tot 23%); NNH=11 (95% BI: -17 tot 4).
Tabel 4. Evidenceprofiel over lichttherapie voor nachtelijke onrust bij mensen met dementie
|
Behandeling uitkomst |
N trials |
Kwaliteit van het bewijs |
n1/ N per groep |
Behandeleffecten |
Algemene beoordeling |
|||||||
|
Vertekend2 |
inconsistent |
Indirect |
Niet precies3 |
Publicatie bias |
licht |
controle |
MD3, min. [95% BI] |
OR [95% BI] |
ARR4 [95% BI] |
|||
|
Lichttherapie |
||||||||||||
|
symptomen |
4 |
nee |
nee |
Nee |
ja |
nee |
71 |
64 |
-18 [-86; 51] |
|
|
laag |
|
klinisch relevante respons |
0 |
|
|
|
|
|
|
|
|
|
|
|
|
>=1 bijwerkingen |
0 |
|
|
|
|
|
|
|
|
|
|
|
|
uitval |
1 |
nee |
n.v.t. |
Nee |
ja |
ja |
5/34 |
2/33 |
|
2,7 [0,5; 14,9] |
9%[-6; 23%] |
laag |
Zoeken en selecteren inzet psychofarmaca
Gevonden studies
Er werden twaalf meta-analyses en 34 RCT’s op volledige tekst beoordeeld. Zes (systematische reviews van) RCT’s voldeden aan de selectiecriteria, waarvan één over trazodon (Camargos, 2014) en vijf over hypnotica (NCT00325728; Dowling, 2008; Singer, 2003; Serfaty, 2002; en Wade, 2014). Overige publicaties zijn weergegeven in de exclusietabel, zie bijlage 1.3.
Samenvatting literatuur inzet psychofarmaca
Kenmerken en kwaliteit van geïncludeerde studies
Tabel 5 geeft een overzicht van de kenmerken en kwaliteit van de geïncludeerde RCT’s.
Antidepressiva
Er was één RCT met 50 mg trazodon (een dosering die onder de gebruikelijke antidepressieve dosering ligt) bij 36 thuiswonende patiënten met lichte tot matige ziekte van Alzheimer en zonder depressie. De RCT had een duur van twee weken en de effectiviteit werd gemeten met behulp van actimetrie. Het risico op bias was hoog, zie tabel 2.3.
Hypnotica
In vier RCT’s werd melatonine onderzocht. In twee daarvan was naast de melatonine- en placebo-interventie voor beide armen een lichtinterventie uitgevoerd: twee uur daglicht (Wade, 2014) en omgevingslicht aangevuld met lichttherapie (Dowling, 2008). Melatoninedoseringen varieerden van twee tot tien mg en hadden deels een vertraagde/gereguleerde afgifte. Studiepopulaties in de vier RCT’s varieerden tussen lichte en ernstige dementie, waarvan drie alleen patiënten met de ziekte van Alzheimer betroffen. In omvang liepen de RCT’s uiteen van dertien tot 157 patiënten en in duur van twee tot twaalf weken. Van drie trials zijn actigrafiedata beschikbaar en van twee vragenlijsten. Het risico op bias was steeds matig tot hoog, zie tabel 2.3.
Tabel 5. Kenmerken en kwaliteit van geïncludeerde RCT’s naar psychofarmaca voor nachtelijke onrust bij mensen met dementie
|
Publicatie |
Medicijn |
Dosis |
Setting |
Dementie (ernst; type)1 |
Nachtelijke onrust (ernst; criteria)2 |
N |
Trialduur, weken |
Meetinstrument2 |
Kwaliteit opzet en uitvoering |
|
Antidepressiva |
|||||||||
|
Camargos 2014 |
trazodon |
50 mg |
thuis |
licht – matig; AD |
volgens patiënt en mantelzorger (NPI-S >=2) |
36 |
2 |
actigrafie |
2/6 |
|
Hypnotica |
|||||||||
|
NCT00325728 |
ramelteon |
8 mg |
NG |
licht – matig; AD |
volgens personeel + actigrafie |
74 |
8 |
actigrafie |
2/6 |
|
Dowling 2008 |
melatonine3 |
5 mg |
instelling |
ernst NG; AD |
volgens personeel |
33 |
10 |
actigrafie |
3/6 |
|
Singer 2003 |
melatonine |
2,5 mg gereguleerde afgifte 10 mg |
instelling + thuis |
licht – ernstig; AD |
volgens actigrafie + SDI |
157 |
10 |
actigrafie |
2/6 |
|
Serfaty 2002 |
melatonine |
6 mg vertraagde afgifte |
instelling + thuis |
matig – ernstig; DSM-IV dementia |
volgens personeel/mantelzorger |
44 |
2 |
actigrafie + vragenlijsten |
3/6 |
|
Wade 2014 |
Melatonine4 |
2 mg Gereguleerde afgifte |
thuis |
licht – matig; AD |
volgens PSQI en slaapdagboek |
13 |
12 |
PSQI |
2/6 |
1 AD: ziekte van Alzheimer; NG: niet gerapporteerd
2 SDI: Sleep Disorders Inventory, vragenlijst afgeleid van de NPI en ontwikkeld voor deze trial (Singer 2003)
PSQI: Pittsburgh Sleep Quality Index, 10 vragen, range 0 tot 21, een hogere score betekent slechtere slaap (Buysse 1989)
3 de melatonine- en placebogroep ontvingen ook lichttherapie
4 de melatonine- en placebogroep ontvingen ook buitenlicht therapie
Resultaten en bewijskracht over effectiviteit van psychofarmaca voor nachtelijke onrust bij mensen met dementie
Tabel 6 toont het evidenceprofiel met de resultaten en bewijskracht over effectiviteit van de geïncludeerde studies. Forest plots zijn te vinden in bijlage 3.
Antidepressiva
Uit actigrafische metingen bleek trazodon de nachtelijke totale slaapduur, die op baseline rond de vijf uur lag, met 42 minuten te verlengen vergeleken met placebo [95% BI: 1 tot 84 minuten]. De kans op een klinisch relevante respons van minimaal een half uur extra nachtelijke slaap zijn berekend uit de gegeven data: OR 2,16 (95% BI: 0,54 tot 8,57) en risicoverschil 18% (95% BI: -13% tot 49%; NNT=5,6)
Hypnotica
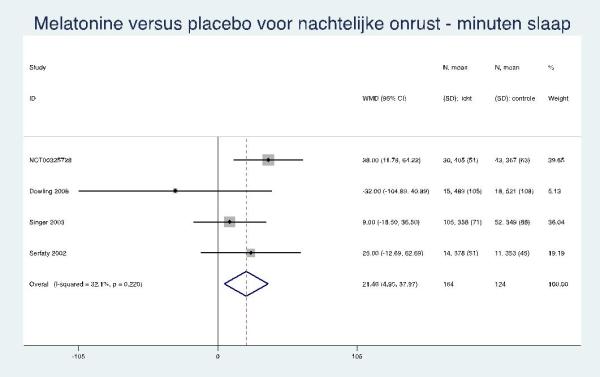
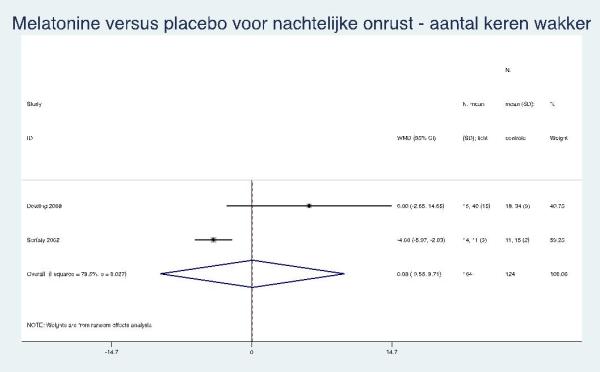
Vier van de vijf RCT’s hebben actimetrie gebruikt (NCT00325728; Dowling, 2008; Singer, 2003; Serfaty, 2002). In onze meta-analyse nam de slaapduur van de melatonine/ramelteongroep versus de placebogroep 21 minuten toe (95% BI: 5 tot 38 minuten) maar de deelnemers waren gemiddeld even vaak wakker (verschil van 0; 95% BI: -10 tot 10). Opvallend was dat de resultaten in de RCT waarbij melatonine (of placebo) werd toegevoegd aan de lichttherapie, de resultaten tegengesteld waren (kortere slaapduur, vaker wakker) aan die in de andere trials (Dowling, 2008).
Twee trials (NCT00325728; Serfaty, 2002) rapporteerden daarnaast resultaten van vragenlijstonderzoek bij personeel en mantelzorgers. Beiden vonden geen verschil op nachtelijke onrust, respectievelijk slaapkwaliteit.
Resultaten en bewijskracht over bijwerkingen van psychofarmaca voor nachtelijke onrust bij mensen met dementie
Antidepressiva
Het risico op het optreden van minimaal één bijwerking bij gebruik van trazodon voor nachtelijke onrust was in deze RCT van 36 patiënten niet verhoogd (OR= 0,49; 95% BI: 0,11 tot 2,16; risicoverschil= -14%; 95% BI: -43% tot 15%). Er was een niet significant verhoogd risico op diarree (OR=2,84; 95% BI: 0,11 tot 74,42; risicoverschil=5%; 95% BI: -9% tot 19%).
Hypnotica
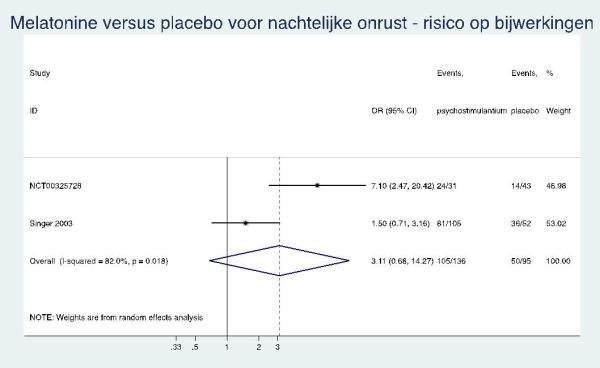
Uit twee RCT’s (NCT00325728 en Singer 2003) konden data worden geëxtraheerd over het optreden van één of meer bijwerkingen voor een meta-analyse. Deze gaf geen significant verschil: OR 3,1 (95% BI: 0,68 tot 14,27) en risicoverschil van 26% (95% BI: -11% tot 62%; NNH=4).
Resultaten en bewijskracht over uitval
Antidepressiva
De kans op uitval was in de trazodontrial niet significant verhoogd (OR=2,00; 95% BI: 0,32 tot 12,62; risicoverschil=9%; 95% BI: -15% tot 33%; NNH=11).
Hypnotica
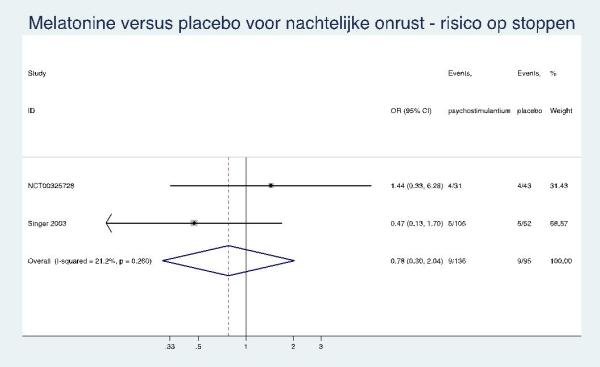
Uitval was in NCT00325728 en Singer 2003 gerapporteerd, waardoor deze kon worden gepoold. Dit gaf als resultaat geen significant verschil in uitval tussen interventie en placebo (OR=0,78; 95% BI: 0,30 tot 2,04; risicoverschil= -20%; 95% BI: -10% tot 6%).
Tabel 6. Evidenceprofiel over psychofarmaca voor nachtelijke onrust bij mensen met dementie
|
Medicatiegroep uitkomst |
N trials |
Kwaliteit van het bewijs |
n1/ N per groep |
Behandeleffecten |
Algemene beoordeling |
|||||||
|
|
Vertekend2 |
inconsistent |
Indirect |
Niet precies3 |
Publicatie bias |
medicatie |
placebo |
MD3 [95% BI] |
OR [95% BI] |
ARR4 [95% BI] |
||
|
Antidepressiva (trazodon) |
||||||||||||
|
symptomen |
1 |
ja |
n.v.t. |
Nee |
nee |
nee |
15/19 |
15/17 |
NG |
|
|
laag |
|
klinisch relevante respons |
1 |
ja |
n.v.t. |
Nee |
nee |
nee |
9/19 |
5/17 |
|
2,16 [0,54; 8,57] |
18% [-13%; 49%] |
laag |
|
>=1 bijwerkingen |
1 |
ja |
n.v.t. |
Nee |
nee |
nee |
4/19 |
6/17 |
|
0,49 [0,11; 2,16] |
-14% [-43%; 15%] |
laag |
|
uitval |
1 |
ja |
n.v.t. |
Nee |
nee |
nee |
4/19 |
2/17 |
|
2,00 [0,32; 12,62] |
9% [-15%; 33%] |
laag |
|
Hypnotica (ramelteon, melatonine) |
||||||||||||
|
symptoomreductie |
4 |
ja |
ja |
nee |
nee |
nee |
164/164 |
124/124 |
21 min. langere slaap [5; 38 min.] even vaak wakker [-10; 10] |
|
|
laag |
|
klinisch relevante respons |
0 |
|
|
|
|
|
|
|
|
|
|
|
|
>=1 bijwerkingen |
2 |
nee |
nee |
Nee |
nee |
ja |
105/136 |
50/95 |
|
3,11* [0,68; 14,27] |
26% * [-11%; 62%] |
matig |
|
uitval |
2 |
nee |
nee |
Nee |
nee |
ja |
9/136 |
9/95 |
|
0,78* [0,30; 2,04] |
-20%* [-10%; 6%] |
matig |
|
Overige medicatie: geen trials |
||||||||||||
Afkortingen: MD = mean difference (verschil tussen groepen in minuten slaap), OR = odds ratio, ARR = Absolute Risico Reductie, BI = betrouwbaarheidsinterval, NG = niet gerapporteerd.
1 n= aantal participanten waarvan data beschikbaar waren voor de uitkomst symptoomreductie, dan wel het aantal participanten met een klinische relevante respons, met >= 1 bijwerkingen, of die uitvielen;
2 = hoge risk of bias;
3 = grote onzekerheid rondom geschatte effect (= BI te breed) door te kleine trials;
4 NNT = 100/ ARR voor respons, en NNH= 100/ ARR voor >= bijwerkingen
* Op basis van een random model
Bijlagen psychosociale of psychologische interventies
Bijlage 1.1 Exclusietabel psychosociale en psychologische interventies voor nachtelijke onrust bij mensen met dementie
|
Referentie |
Reden van exclusie |
|
Primaire studies (RCT’s) voor nachtelijk onrustig gedrag |
|
|
Connell, B. R., Sanford, J. A., & Lewis, D. (2007). Therapeutic effects of an outdoor activity program on nursing home residents with dementia. Journal of Housing for the Elderly, 21(3-4), 194-209. |
Geen specifieke indicatie nachtelijke onrust |
|
McCurry, S. M., Gibbons, L. E., Logsdon, R. G., Vitiello, M., & Teri, L. (2003). Training Caregivers to Change the Sleep Hygiene Practices of Patients with Dementia: The NITE‐AD Project. Journal of the American Geriatrics Society, 51(10), 1455-1460. |
Geen effectstudie (haalbaarheidsstudie) |
|
McCurry S.M., Logsdon R.G., Gibbons L.E., Vitiello M.V., & Teri L. (2006) Behavioral treatment for sleep disturbances in Alzheimer's disease: The NITE-AD study. Research and Practice in Alzheimer's Disease (11), 341-346. |
Doublure McCurry 2005 |
|
Middleton, L., Goodson, W., Poelke, G., Santos-Modesitt, W., Yaffe, K., & Barnes, D. (2012). Impact of a 12-week exercise intervention on noncognitive outcomes in sedentary elders with cognitive complaints or MCI: Findings from the MAX Trial. Alzheimer's & Dementia, 8(4), P146. |
Conferentie-abstract |
|
Rodríguez-Mansilla, J., González-López-Arza, M. V., Varela-Donoso, E., Montanero-Fernández, J., Jiménez-Palomares, M., & Garrido-Ardila, E. M. (2013). Ear therapy and massage therapy in elderly people with dementia a pilot study. Journal of Traditional Chinese Medicine, 33(4), 461-467. |
Geen specifieke indicatie nachtelijke onrust |
|
Systematische reviews voor nachtelijk onrustig gedrag |
---- |
|
O'Neil, M. E., Freeman, M., Christensen, V., Telerant, R., Addleman, A., & Kansagara, D. (2011). A systematic evidence review of non-pharmacological interventions for behavioral symptoms of dementia. Washington, DC: Department of Veterans Affairs.
Waarvan twee RCT's gericht op nachtelijke onrust:
Alessi, C. A., Yoon, E. J., Schnelle, J. F., Al‐Samarrai, N. R., & Cruise, P. A. (1999). A randomized trial of a combined physical activity and environmental intervention in nursing home residents: do sleep and agitation improve?. Journal of the American Geriatrics Society, 47(7), 784-791. |
Van de 3 RCT’s zijn er 2 geëxcludeerd
Geen specifieke indicatie nachtelijke onrust |
|
Alessi, C. A., Martin, J. L., Webber, A. P., Cynthia Kim, E., Harker, J. O., & Josephson, K. R. (2005). Randomized, controlled trial of a nonpharmacological intervention to improve abnormal sleep/wake patterns in nursing home residents. Journal of the American Geriatrics Society, 53(5), 803-810. |
Niet op dementie geïncludeerd |
Bijlage 2.1. Risk-of-bias psychosociale en psychologische interventies
|
|
1. randomisatie-proces |
2. afwijkingen van beoogde interventie |
3. ontbrekende uitkomsten |
4. uitkomstmetingen |
5. selectieve rapportage |
6. overig |
totaal aantal items zonder bias |
|
McCurry 2005 |
Wel bias1.1 |
Wel bias1.2 |
Geen bias |
Geen bias |
Geen bias |
Geen bias |
4/6 |
|
McCurry 2011 |
Geen bias |
Wel bias2.2 |
Geen bias |
Wel bias2.3 |
Geen bias |
Geen bias |
4/6 |
|
Harris 2012 |
Wel bias3.1 |
Wel bias3.2 |
Geen bias |
Geen bias |
Wel bias3.3 |
Wel bias3.4 |
2/6 |
Onduidelijk /geen bias/ wel bias; 1-2 = matig, 3-4 = redelijk, 5-6 = goed.
Noten:
1.1. wel random numbers, geen info over sealed envelopes
1.2. geen blindering zorg
1.3. ITT
1.4. (de bewegingsmonitor is niet de standaard voor slaapmonitoring)
2.1. random sequence numbers and concealed enveloppes
2.2. geen blindering zorg; niet alle sessie gevolgd
2.3. ITT
2.4. bewegingsmonitor niet altijd gebruikt, sleep disorders subjectief
3.1. Random numbers table, geen sealed envelop
3.2. Interventie door onderzoeker/ auteur
3.3. Geen uitval
3.4. Geen bias (bewegingsmonitor)
3.5. Niet alle resultaten gepresenteerd (gem uitkomsten, SDs, sign)
3.6. Wel bias (storende factor andere bewoners, vph regime; info over deze beïnvloedende factoren zijn niet gerapporteerd)
Bijlagen inzet lichttherapie
Bijlage 1.2 Exclusietabel lichttherapie voor nachtelijke onrust bij mensen met dementie
|
Referentie |
Reden van exclusie |
|
Primaire studies |
|
|
Ancoli-Israel, S., Martin, J. L., Kripke, D. F., Marler, M., & Klauber, M. R. (2002). Effect of light treatment on sleep and circadian rhythms in demented nursing home patients. Journal of the American Geriatrics Society, 50(2), 282–289. |
geen indicatie nachtelijke onrust |
|
Ancoli-Israel, S., Gehrman, P., Martin, J. L., Shochat, T., Marler, M., Corey-Bloom, J., & Levi, L. (2003). Increased light exposure consolidates sleep and strengthens circadian rhythms in severe Alzheimer’s disease patients. Behavioral Sleep Medicine, 1(1), 22–36. |
geen indicatie nachtelijke onrust |
|
Ancoli-Israel, S., Martin, J. L., Gehrman, P., Shochat, T., Corey-Bloom, J., Marler, M., … Levi, L. (2003). Effect of light on agitation in institutionalized patients with severe Alzheimer disease. The American Journal of Geriatric Psychiatry : Official Journal of the American Association for Geriatric Psychiatry, 11(2), 194–203. |
geen indicatie nachtelijke onrust |
|
Burns, A., Allen, H., Tomenson, B., Duignan, D., & Byrne, J. (2009). Bright light therapy for agitation in dementia: a randomized controlled trial. International Psychogeriatrics / IPA, 21(4), 711–721 |
geen indicatie nachtelijke onrust |
|
Colenda, C. C., Cohen, W., McCall, W. V, & Rosenquist, P. B. (1997). Phototherapy for patients with Alzheimer disease with disturbed sleep patterns: results of a community-based pilot study. Alzheimer Disease and Associated Disorders, 11(3), 175–178. |
geen controlegroep |
|
Dowling, G. A., Graf, C. L., Hubbard, E. M., & Luxenberg, J. S. (2007). Light treatment for neuropsychiatric behaviors in Alzheimer’s disease. Western Journal of Nursing Research, 29(8), 961–975. |
naast nachtelijke onrust ook indicatie sundowning en slaperigheid overdag |
|
Fetveit, A., Skjerve, A., & Bjorvatn, B. (2003). Bright light treatment improves sleep in institutionalised elderly--an open trial. International Journal of Geriatric Psychiatry, 18(6), 520–526. |
geen controlegroep |
|
Figueiro, M. G., Plitnick, B. A., Lok, A., Jones, G. E., Higgins, P., Hornick, T. R., & Rea, M. S. (2014). Tailored lighting intervention improves measures of sleep, depression, and agitation in persons with Alzheimer’s disease and related dementia living in long-term care facilities. Clinical Interventions in Aging, 9, 1527–1537. |
geen parallel/controlegroep |
|
Friedman, L., Spira, A. P., Hernandez, B., Mather, C., Sheikh, J., Ancoli-Israel, S., … Zeitzer, J. M. (2012). Brief morning light treatment for sleep/wake disturbances in older memory-impaired individuals and their caregivers. Sleep Medicine, 13(5), 546–549. |
geen indicatie nachtelijke onrust |
|
Kobayashi, R., Fukuda, N., Kohsaka, M., Sasamoto, Y., Sakakibara, S., Koyama, E., … Koyama, T. (2001). Effects of bright light at lunchtime on sleep of patients in a geriatric hospital I. Psychiatry and Clinical Neurosciences, 55(3), 287–289. |
geen controlegroep |
|
Lyketsos, C. G., Lindell Veiel, L., Baker, A., & Steele, C. (1999). A randomized, controlled trial of bright light therapy for agitated behaviors in dementia patients residing in long-term care. International Journal of Geriatric Psychiatry, 14(7), 520–525. |
geen indicatie nachtelijke onrust |
|
McCurry, S. M., Gibbons, L. E., Logsdon, R. G., Vitiello, M. V, & Teri, L. (2005). Nighttime insomnia treatment and education for Alzheimer’s disease: a randomized, controlled trial. Journal of the American Geriatrics Society, 53(5), 793–802. |
Lichttherapie onderdeel van psychosociale combinatie-therapie, trial is beschreven in review psychologische en psychosociale interventies. |
|
Mishima, K., Okawa, M., Hishikawa, Y., Hozumi, S., Hori, H., & Takahashi, K. (1994). Morning bright light therapy for sleep and behavior disorders in elderly patients with dementia. Acta Psychiatrica Scandinavica, 89(1), 1–7. |
geen controlegroep |
|
Mishima, K., Hishikawa, Y., & Okawa, M. (1998). Randomized, dim light controlled, crossover test of morning bright light therapy for rest-activity rhythm disorders in patients with vascular dementia and dementia of Alzheimer’s type. Chronobiology International, 15(6), 647–654. |
patiënten vormen eigen controles |
|
Pincock, S. (2003, August). Light boxes can help older people with dementia. BMJ (Clinical Research Ed.). News, England. http://doi.org/10.1136/bmj.327.7413.468-b |
nieuwsbericht |
|
Riemersma-van der Lek, R. F., Swaab, D. F., Twisk, J., Hol, E. M., Hoogendijk, W. J., & Van Someren, E. J. (2008). Effect of Bright Light and Melatonin on Cognitive and Noncognitive Function in Elderly Residents of Group Care Facilities. Jama, 299(22), 2642. |
geen indicatie nachtelijke onrust |
|
Satlin, A., Volicer, L., Ross, V., Herz, L., & Campbell, S. (1992). Bright light treatment of behavioral and sleep disturbances in patients with Alzheimer’s disease. The American Journal of Psychiatry, 149(8), 1028–1032. |
geen controlegroep |
|
Skjerve, A., Holsten, F., Aarsland, D., Bjorvatn, B., Nygaard, H. A., & Johansen, I. M. (2004). Improvement in behavioral symptoms and advance of activity acrophase after short-term bright light treatment in severe dementia. Psychiatry and Clinical Neurosciences, 58(4), 343–347. |
geen controlegroep |
|
Systematische reviews |
|
|
van Maanen, A., Meijer, A. M., van der Heijden, K. B., & Oort, F. J. (2015). The effects of light therapy on sleep problems: A systematic review and meta-analysis. Sleep Med Rev, 29, 52–62. |
geen volledige overlap met studies die voldoen aan onze criteria |
|
Forbes, D., Blake, C. M., Thiessen, E. J., Peacock, S., & Hawranik, P. (2014). Light therapy for improving cognition, activities of daily living, sleep, challenging behaviour, and psychiatric disturbances in dementia. Cochrane Database Syst Rev, 2, Cd003946. |
geen volledige overlap met studies die voldoen aan onze criteria |
Bijlage 2.2. Risk-of-bias lichttherapie
|
|
1. randomisatie proces |
2. afwijkingen van beoogde interventie |
3. ontbrekende uitkomsten |
4. uitkomstmetingen |
5. selectieve rapportage |
6. overig |
totaal aantal items zonder bias |
|
McCurry 2011 |
geen bias |
geen bias |
wel bias |
wel bias* |
geen bias |
geen bias |
4 |
|
Dowling 2008 |
onduidelijk |
onduidelijk |
onduidelijk |
geen bias |
geen bias |
geen bias |
3 |
|
Nowak 2008 |
onduidelijk |
onduidelijk |
geen bias |
wel bias |
geen bias |
geen bias |
3 |
|
Fontana Gasio 2003 |
onduidelijk |
onduidelijk |
wel bias |
geen bias |
geen bias |
wel bias |
2 |
*deze beoordeling appendix McCurry 2011 er in RoB wel bias is gescoord voor item 4, geldt voor actimetriedata geen bias.
Bijlagen inzet psychofarmaca
Bijlage 1.3 Exclusietabel psychofarmaca voor nachtelijke onrust bij mensen met dementie (na lezen van volledig artikel)
|
Referentie |
Reden van exclusie |
|
Primaire studies |
|
|
Asayama, K., Yamadera, H., Ito, T., Suzuki, H., Kudo, Y., & Endo, S. (2003). Double blind study of melatonin effects on the sleep-wake rhythm, cognitive and non-cognitive functions in Alzheimer type dementia. J Nippon Med Sch, 70(4), 334–341. |
geen indicatie nachtelijke onrust |
|
Bachinskaya, N., Hoerr, R., & Ihl, R. (2011). Alleviating neuropsychiatric symptoms in dementia: the effects of Ginkgo biloba extract EGb 761. Findin from a randomized controlled trial. Neuropsychiatr Dis Treat, 7, 209–215. |
geen indicatie nachtelijke onrust |
|
Ballard, C., Margallo-Lana, M., Juszczak, E., Douglas, S., Swann, A., Thomas, A., … Jacoby, R. (2005). Quetiapine and rivastigmine and cognitive decline in Alzheimer’s disease: randomised double blind placebo controlled trial. BMJ (Clinical Research Ed.), 330(7496), 874. |
geen indicatie nachtelijke onrust |
|
Ballard, C., Thomas, A., Gerry, S., Yu, L. M., Aarsland, D., Merritt, C., … Walker, Z. (2015). A double-blind randomized placebo-controlled withdrawal trial comparing memantine and antipsychotics for the long-term treatment of function and neuropsychiatric symptoms in people with Alzheimer’s disease (MAIN-AD). J Am Med Dir Assoc, 16(4), 316–322 |
niet placebo-gecontroleerd |
|
Boxer, A. L., Knopman, D. S., Kaufer, D. I., Grossman, M., Onyike, C., Graf-Radford, N., … Miller, B. L. (2013). Memantine in patients with frontotemporal lobar degeneration: a multicentre, randomised, double-blind, placebo-controlled trial. Lancet Neurol, 12(2), 149–156. Journal Article. |
niet specifiek op nachtelijke onrust |
|
Brodaty, H., Corey-Bloom, J., Potocnik, F. C. V, Truyen, L., Gold, M., & Damaraju, C. R. V. (2005). Galantamine prolonged-release formulation in the treatment of mild to moderate Alzheimer’s disease. Dementia and Geriatric Cognitive Disorders, 20(2–3), 120–132. |
geen indicatie nachtelijke onrust |
|
Cummings, J. L., McRae, T., & Zhang, R. (2006). Effects of donepezil on neuropsychiatric symptoms in patients with dementia and severe behavioral disorders. Am J Geriatr Psychiatry, 14(7), 605–612. |
geen indicatie nachtelijke onrust |
|
Erkinjuntti, T., Kurz, A., Gauthier, S., Bullock, R., Lilienfeld, S., & Damaraju, C. V. (2002). Efficacy of galantamine in probable vascular dementia and Alzheimer’s disease combined with cerebrovascular disease: a randomised trial. Lancet (London, England), 359(9314), 1283–1290. |
geen indicatie nachtelijke onrust |
|
Gauthier, S., Feldman, H., Hecker, J., Vellas, B., Emir, B., & Subbiah, P. (2002). Functional, cognitive and behavioral effects of donepezil in patients with moderate Alzheimer’s disease. Current Medical Research and Opinion, 18(6), 347–354. |
geen indicatie nachtelijke onrust |
|
Gavrilova, S. I., Preuss, U. W., Wong, J. W. M., Hoerr, R., Kaschel, R., & Bachinskaya, N. (2014). Efficacy and safety of Ginkgo biloba extract EGb 761 in mild cognitive impairment with neuropsychiatric symptoms: a randomized, placebo-controlled, double-blind, multi-center trial. International Journal of Geriatric Psychiatry, 29(10), 1087–1095. |
niet in een populatie met dementie |
|
Gehrman, P. R., Connor, D. J., Martin, J. L., Shochat, T., Corey-Bloom, J., & Ancoli-Israel, S. (2009). Melatonin fails to improve sleep or agitation in double-blind randomized placebo-controlled trial of institutionalized patients with Alzheimer disease. Am J Geriatr Psychiatry, 17(2), 166–169. |
geen indicatie nachtelijke onrust |
|
Holmes, C., Wilkinson, D., Dean, C., Vethanayagam, S., Olivieri, S., Langley, A., … Damms, J. (2004). The efficacy of donepezil in the treatment of neuropsychiatric symptoms in Alzheimer disease. Neurology, 63(2), 214–219. |
geen indicatie nachtelijke onrust |
|
Ihl, R., Bachinskaya, N., Korczyn, A. D., Vakhapova, V., Tribanek, M., Hoerr, R., & Napryeyenko, O. (2011). Efficacy and safety of a once-daily formulation of Ginkgo biloba extract EGb 761 in dementia with neuropsychiatric features: a randomized controlled trial. Int J Geriatr Psychiatry, 26(11), 1186–1194. |
geen indicatie nachtelijke onrust |
|
Ihl, R., Tribanek, M., Bachinskaya, N., & Group, G. S. (2012). Efficacy and tolerability of a once daily formulation of Ginkgo biloba extract EGb 761 in Alzheimer’s disease and vascular dementia: results from a randomised controlled trial. Pharmacopsychiatry, 45(2), 41–46. |
geen indicatie nachtelijke onrust |
|
Johannsen, P., Salmon, E., Hampel, H., Xu, Y., Richardson, S., Qvitzau, S., & Schindler, R. (2006). Assessing therapeutic efficacy in a progressive disease: a study of donepezil in Alzheimer’s disease. CNS Drugs, 20(4), 311–325. |
geen indicatie nachtelijke onrust |
|
Kertesz, A., Morlog, D., Light, M., Blair, M., Davidson, W., Jesso, S., & Brashear, R. (2008). Galantamine in frontotemporal dementia and primary progressive aphasia. Dement Geriatr Cogn Disord, 25(2), 178–185. |
geen indicatie nachtelijke onrust |
|
Mori, E., Ikeda, M., & Kosaka, K. (2012). Donepezil for dementia with Lewy bodies: a randomized, placebo-controlled trial. Ann Neurol, 72(1), 41–52. Journal Article. |
geen indicatie nachtelijke onrust |
|
Napryeyenko, O., & Borzenko, I. (2007). Ginkgo biloba special extract in dementia with neuropsychiatric features. A randomised, placebo-controlled, double-blind clinical trial. Arzneimittel-Forschung, 57(1), 4–11. |
geen indicatie nachtelijke onrust |
|
Nikolova G , Yancheva S , Raychev I, H. R. (2013). Ginkgo biloba extract in dementia: A 22-week randomised, placebo-controlled, double-blind trial . Bulgarian Neurology, 14, 139 – 143. |
publicatie in Bulgaars |
|
Reisberg, B., Doody, R., Stoffler, A., Schmitt, F., Ferris, S., & Mobius, H. J. (2003). Memantine in moderate-to-severe Alzheimer’s disease. The New England Journal of Medicine, 348(14), 1333–1341. |
geen indicatie nachtelijke onrust |
|
Riemersma-van der Lek, R. F., Swaab, D. F., Twisk, J., Hol, E. M., Hoogendijk, W. J., & Van Someren, E. J. (2008). Effect of Bright Light and Melatonin on Cognitive and Noncognitive Function in Elderly Residents of Group Care Facilities. Jama, 299(22), 2642. |
geen indicatie nachtelijke onrust |
|
Rockwood, K., Mintzer, J., Truyen, L., Wessel, T., & Wilkinson, D. (2001). Effects of a flexible galantamine dose in Alzheimer’s disease: a randomised, controlled trial. Journal of Neurology, Neurosurgery, and Psychiatry, 71(5), 589–595 |
geen indicatie nachtelijke onrust |
|
Scoralick, F. M., Louzada, L. L., Quintas, J. L., Naves, J. O., Camargos, E. F., & Nobrega, O. T. (2016). Mirtazapine does not improve sleep disorders in Alzheimer’s disease: results from a double-blind, placebo-controlled pilot study. Psychogeriatrics. |
slechts deel populatie gerandomiseerd |
|
Tariot, P. N., Cummings, J. L., Katz, I. R., Mintzer, J., Perdomo, C. A., Schwam, E. M., & Whalen, E. (2001). A randomized, double-blind, placebo-controlled study of the efficacy and safety of donepezil in patients with Alzheimer’s disease in the nursing home setting. Journal of the American Geriatrics Society, 49(12), 1590–1599. |
geen indicatie nachtelijke onrust |
|
van Dyck, C. H., Tariot, P. N., Meyers, B., & Malca Resnick, E. (2007). A 24-week randomized, controlled trial of memantine in patients with moderate-to-severe Alzheimer disease. Alzheimer Disease and Associated Disorders, 21(2), 136–143. |
geen indicatie nachtelijke onrust |
|
Vercelletto, M., Boutoleau-Bretonniere, C., Volteau, C., Puel, M., Auriacombe, S., Sarazin, M., … Lacomblez, L. (2011). Memantine in behavioral variant frontotemporal dementia: negative results. J Alzheimers Dis, 23(4), 749–759. |
geen indicatie nachtelijke onrust |
|
Walther, S., Schupbach, B., Seifritz, E., Homan, P., & Strik, W. (2011, April). Randomized, controlled crossover trial of dronabinol, 2.5 mg, for agitation in 2 patients with dementia. Journal of Clinical Psychopharmacology. |
te kleine populatie (n=2) |
|
Winblad, B., Engedal, K., Soininen, H., Verhey, F., Waldemar, G., Wimo, A., … Subbiah, P. (2001). A 1-year, randomized, placebo-controlled study of donepezil in patients with mild to moderate AD. Neurology, 57(3), 489–495. |
geen indicatie nachtelijke onrust |
|
Systematische reviews |
|
|
Treatment of Parkinson’s disease. Psychological disorders: striking a balance in order to optimise antiparkinsonian treatment. (2011). Prescrire Int, 20(120), 242–245. |
geen indicatie nachtelijke onrust |
|
Kavanagh, S., Gaudig, M., Van Baelen, B., Adami, M., Delgado, A., Guzman, C., … Schauble, B. (2011). Galantamine and behavior in Alzheimer disease: analysis of four trials. Acta Neurol Scand, 124(5), 302–308. |
geen indicatie nachtelijke onrust |
|
Lockhart, I. A. A., Orme, M. E. E., & Mitchell, S. A. A. (2011). The efficacy of licensed-indication use of donepezil and memantine monotherapies for treating behavioural and psychological symptoms of dementia in patients with Alzheimer’s disease: systematic review and meta-analysis. Dement Geriatr Cogn Dis Extra, 1(1), 212–227. |
geen indicatie nachtelijke onrust |
|
McCleery, J., Cohen, D. A., & Sharpley, A. L. (2014). Pharmacotherapies for sleep disturbances in Alzheimer’s disease. Cochrane Database Syst Rev, 3, Cd009178. |
geen volledige overlap met studies die voldoen aan onze criteria |
|
Seitz, D. P., Gill, S. S., Herrmann, N., Brisbin, S., Rapoport, M. J., Rines, J., … Conn, D. K. (2013). Pharmacological treatments for neuropsychiatric symptoms of dementia in long-term care: a systematic review. Int Psychogeriatr, 25(2), 185–203. |
geen indicatie nachtelijke onrust |
|
Stinton, C., McKeith, I., Taylor, J. P., Lafortune, L., Mioshi, E., Mak, E., … O’Brien, J. T. (2015). Pharmacological Management of Lewy Body Dementia: A Systematic Review and Meta-Analysis. Am J Psychiatry, 172(8), 731–742. |
geen indicatie nachtelijke onrust |
|
Tan, M. S., Yu, J. T., Tan, C. C., Wang, H. F., Meng, X. F., Wang, C., … Tan, L. (2015). Efficacy and adverse effects of ginkgo biloba for cognitive impairment and dementia: a systematic review and meta-analysis. J Alzheimers Dis, 43(2), 589–603. |
geen indicatie nachtelijke onrust |
|
von Gunten, A., Schlaefke, S., & Uberla, K. (2015). Efficacy of Ginkgo biloba extract EGb 761 in dementia with behavioural and psychological symptoms: A systematic review. The World Journal of Biological Psychiatry : The Official Journal of the World Federation of Societies of Biological Psychiatry, 1–12. |
geen indicatie nachtelijke onrust |
|
Wang, J., Yu, J. T., Wang, H. F., Meng, X. F., Wang, C., Tan, C. C., & Tan, L. (2015). Pharmacological treatment of neuropsychiatric symptoms in Alzheimer’s disease: a systematic review and meta-analysis. J Neurol Neurosurg Psychiatry, 86(1), 101–109. |
geen indicatie nachtelijke onrust |
|
Wild, R., Pettit, T., Burns, A., R., W., T., P., & A., B. (2003). Cholinesterase inhibitors for dementia with Lewy bodies. Cochrane Database Syst Rev, (3), Cd003672. |
geen indicatie nachtelijke onrust |
|
Xu, J., Wang, L. L., Dammer, E. B., Li, C. B., Xu, G., Chen, S. D., … G., W. (2015). Melatonin for sleep disorders and cognition in dementia: a meta-analysis of randomized controlled trials. Am J Alzheimers Dis Other Demen, 30(5), 439–447. |
geen volledige overlap met studies die voldoen aan onze criteria |
|
Zhang, W., Chen, X. Y., Su, S. W., Jia, Q. Z., Ding, T., Zhu, Z. N., & Zhang, T. (2016). Exogenous melatonin for sleep disorders in neurodegenerative diseases: a meta-analysis of randomized clinical trials. Neurol Sci, 37(1), 57–65. |
geen volledige overlap met studies voldoen die aan onze criteria |
Bijlage 2.3. Risk-of-bias psychofarmaca
|
|
1. randomisatie proces |
2. afwijkingen van beoogde interventie |
3. ontbrekende uitkomsten |
4. uitkomstmetingen |
5. selectieve rapportage |
6. overig |
items zonder bias (n) |
|
Camargos 2014 |
onduidelijk |
onduidelijk |
wel bias |
geen bias |
geen bias |
wel bias |
2 |
|
NCT00325728 |
onduidelijk |
onduidelijk |
geen bias |
geen bias |
wel bias |
wel bias |
2 |
|
Dowling 2008 |
wel bias |
onduidelijk |
onduidelijk |
geen bias |
geen bias |
geen bias |
3 |
|
Singer 2003 |
onduidelijk |
onduidelijk |
wel bias |
geen bias |
geen bias |
wel bias |
2 |
|
Serfaty 2002 |
onduidelijk |
onduidelijk |
wel bias |
geen bias |
geen bias |
geen bias |
3 |
|
Wade 2014 |
wel bias |
geen bias |
wel bias |
geen bias |
onduidelijk |
wel bias |
2 |
Bijlage 3 Forest plots psychofarmaca voor nachtelijke onrust bij mensen met dementie
Referenties
Brown DT, Westbury JL, Schüz B. Sleep and agitation in nursing home residents with and without dementia. Int Psychogeriatr 2015: 27: 1945-55.
Buysse, D. J., Reynolds, C. F. 3rd, Monk, T. H., Berman, S. R., & Kupfer, D. J. (1989). The Pittsburgh Sleep Quality Index: a new instrument for psychiatric practice and research. Psychiatry Research, 28(2), 193–213. Journal Article, Research Support, U.S. Gov’t, P.H.S.
Camargos, E. F., Louzada, L. L., Quintas, J. L., Naves, J. O., Louzada, F. M., & Nobrega, O. T. (2014). Trazodone improves sleep parameters in Alzheimer disease patients: a randomized, double-blind, and placebo-controlled study. Am J Geriatr Psychiatry, 22(12), 1565–1574.
Dowling, G. A., Burr, R. L., Van Someren, E. J., Hubbard, E. M., Luxenberg, J. S., Mastick, J., & Cooper, B. A. (2008). Melatonin and bright-light treatment for rest-activity disruption in institutionalized patients with Alzheimer’s disease. J Am Geriatr Soc, 56(2), 239–246.
Fontana Gasio, P., Kräuchi, K., Cajochen, C., Van Someren, E., Amrhein, I., Pache, M., … Wirz-Justice, A. (2003). Dawn-dusk simulation light therapy of disturbed circadian rest-activity cycles in demented elderly. Exp Gerontol, 38(1–2), 207–216.
Hanning, R., Hardeman, F., Leeuw, J. van der, Linden, B. van der (2016). Ruim 50 alternatieven voor vrijheidsbeperking in de zorg. Een praktisch hulp- en inspiratiemiddel bij het afbouwen van vrijheidsbeperking. Vilans ISBN 978-90-8839-094-4. http://www.vilans.nl/docs/VerbeterwijzerVBM/Alternatievenbundel.pdf.
Harris, M., Richards, K. C., & Grando, V. T. (2012). The Effects of Slow-Stroke Back Massage on Minutes of Nighttime Sleep in Persons With Dementia and Sleep Disturbances in the Nursing Home A Pilot Study. Journal of Holistic Nursing, 30(4), 255-263.
McCurry, S. M., Pike, K. C., Vitiello, M. V, Logsdon, R. G., Larson, E. B., & Teri, L. (2011). Increasing walking and bright light exposure to improve sleep in community-dwelling persons with Alzheimer’s disease: results of a randomized, controlled trial. Journal of the American Geriatrics Society, 59(8), 1393–1402. Comparative Study, Journal Article, Randomized Controlled Trial, Research Support, N.I.H., Extramural, Research Support, Non-U.S. Gov’t.
NCT00325728. (n.d.). A Double-Blind, Randomized, Placebo-Controlled Study of the Efficacy, Safety and Tolerability of 8 Week Treatment of Rozerem 8 mg (QHS) in Sleep Disturbed, Mild to Moderately Severe Alzheimer’s Disease Subjects. Www.takeda.com. Retrieved from http://www.takeda.com/research/ct/pdf/report/15_Ramelteon_01-05-TL-375-061_ClinicalTrialSynopsis_NCT00325728_en.pdf
Niemeijer, A., Depla M., Frederiks, B., Hertogh, C. (2012). Toezichthoudende domotica. Een handreiking voor zorginstellingen. VUMC.
Nowak. (2008). The effect of timed blue-green light on sleep-wake patterns in women with Alzheimer’s disease. Dissertation Abstracts International, Section B:(69(6-B)), 1–154. Retrieved from https://books.google.nl/books?id=oRhAhshcCvEC&lpg=PR2&ots=uh5le5LFhl&dq=The effect of timed blue-green light on sleep-wake patterns in women with Alzheimer’s disease&lr&hl=nl&pg=PA17#v=onepage&q=The effect of timed blue-green light on sleep-wake p
Serfaty, M., Kennell-Webb, S., Warner, J., Blizard, R., & Raven, P. (2002). Double blind randomised placebo controlled trial of low dose melatonin for sleep disorders in dementia. Int J Geriatr Psychiatry, 17(12), 1120–1127.
Singer, C., Tractenberg, R. E., Kaye, J., Schafer, K., Gamst, A., Grundman, M., … Thal, L. J. (2003). A multicenter, placebo-controlled trial of melatonin for sleep disturbance in Alzheimer’s disease. Sleep, 26(7), 893–901. Journal Article.
Sloane, P. D., Figueiro, M., Garg, S., Cohen, L. W., Reed, D., Williams, C. S., … Zimmerman, S. (2015). Effect of home-based light treatment on persons with dementia and their caregivers. Lighting Research & Technology (London, England : 2001), 47(2), 161–176. JOURNAL ARTICLE.
Tractenberg, R. E., Singer, C. M., Cummings, J. L., & Thal, L. J. (2003). The Sleep Disorders Inventory: an instrument for studies of sleep disturbance in persons with Alzheimer’s disease. Journal of Sleep Research, 12(4), 331–337. Journal Article, Research Support, U.S. Gov’t, P.H.S.
Wade, A. G., Farmer, M., Harari, G., Fund, N., Laudon, M., Nir, T., … Zisapel, N. (2014). Add-on prolonged-release melatonin for cognitive function and sleep in mild to moderate Alzheimer’s disease: a 6-month, randomized, placebo-controlled, multicenter trial. Clin Interv Aging, 9, 947–961.

